建立台灣新型嚴重特殊傳染性肺炎研究網及資料庫
(一)緣起
中國武漢市2019年12月起爆發新型嚴重肺炎疫情,並擴散中國各省及世界各國,世衛將其命名為2019新型冠狀病毒(Novel coronavirus, 2019-nCoV)。此感染性肺炎已成為世界重要疾病,截至2020年2月18日止,我國疾管署統計結果顯示,國內已有22名確診。
為了加速對新型冠狀病毒造成嚴重特殊傳染性肺炎的成因有更進一步的瞭解,以及促進國內學研與醫療機構對防疫基礎研究及治療策略開發的合作,陳時中部長指示,要國衛院收集全國新冠肺炎病人檢體,以及提出資訊公開共享規劃。
(二)規劃
由司徒惠康副院長確定本計畫名稱為:台灣新型嚴重特殊傳染性肺炎研究網及資料庫之建立。藉由整合平台的網絡,在符合生物安全操作標準條件下,遵循一個標準流程,快速且有系統地自全台灣合作醫院收集新型嚴重特殊傳染性肺炎病人的相關檢體及臨床資料,並進行加值分析,據此建立一個大型的檢體庫及資料庫供全國的產學研醫界申請使用,以加速整體防疫研究之進行,並促進國內學研與醫療機構對防疫基礎研究及治療策略開發的合作。
由於初建立時,國內所有的biobank都不收集感染性檢體,因此所有檢體和臨床資訊都保管在國家衛生研究院人體生物資料庫,一切皆依照《傳染病防治法》和人體生物資料庫管理條例之規定執行所有收集和運用檢體流程,並邀集相關專家組成專屬科學審查委員會,審查相關申請案,以最友善和公開公平的方式提供國內各界申請運用。我們也規劃將收案之病例檢體進行加值分析,包含DNA全基因定序和RNA的基因定序研究,這些數據除了可以提供申請使用者進一步作多方位之分析,並可以用來參與國際合作研究,以加速整體防疫研究之進行,就達到造福國人的目的。
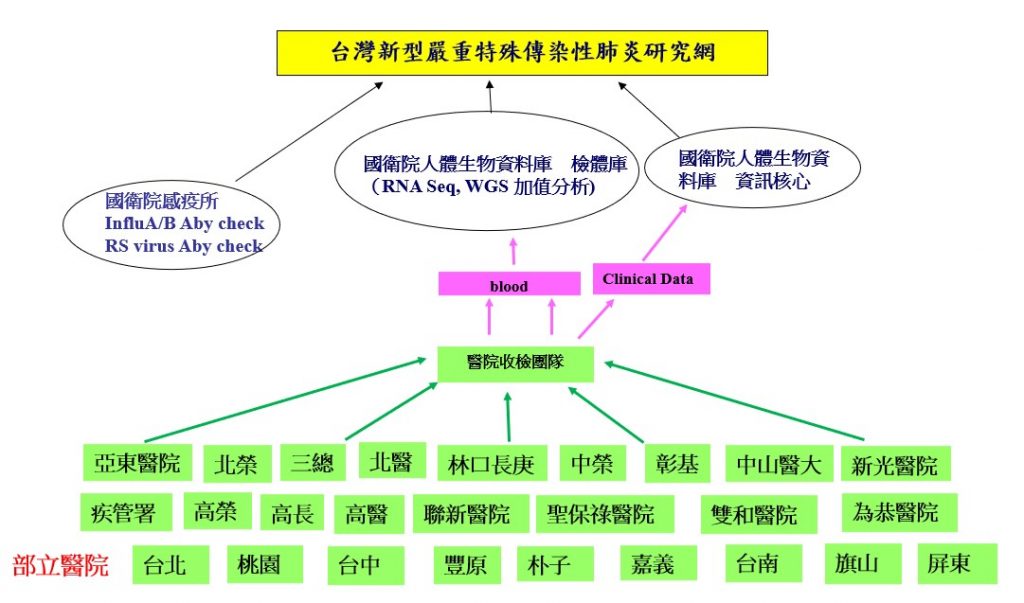
圖1、台灣新型嚴重特殊傳染性肺炎研究網及資料庫之架構
(三)加值服務
本資料庫也對肺炎病人(COVID-19 陽性和陰性)血液DNA進行全基因定序和RNA 表現的分析,並儲存在國衛院人體生物資料庫之資訊核心,截至於2021年12月底,已完成 165個COVID-19 陽性和15個COVID-19陰性病例基因定序數據。由於這個基因定序的一級分析數據相當龐大,國衛院人體生物資料庫之資訊核心特地在主機房擴大儲存陣列以及機房機櫃來儲存。在加上醫療資訊後,COVID-19基因醫療大數據已於2021年8月,提供外界申請運用。由於全基因定序牽涉個資保護,而且資料寶貴,所以此COVID-19基因醫療大數據的分析運用,採取資料不落地的措施,申請人必須來到國衛院人體生物資料庫之資訊核心之獨立作業區分析資料。
(四)開放申請運用
台灣新型嚴重特殊傳染性肺炎研究網及資料庫在2020年3月即開放外界申請運用,產學研界都非常積極來申請。
(五)重要成果
1.成為國家重要公共財:
食藥署第一批自國衛院人體生物資料庫申請之新冠肺炎康復患者血清已於2020年末製作出新冠病毒中和抗體國家標準品,當時邀請國內共五間三級實驗室(含食藥署)進行共同標定,另提供國際標準品(NIBSC製備)進行平行比對,訂定國家標準品的中和抗體數值。除了解決國內無中和抗體標準品之困境並迅速地協助各實驗室進行中和抗體檢測方法最佳化,也替國內的新冠肺炎疫苗之免疫原性檢測奠定良好的檢測平台。食藥署中和抗體國家標準品製備後已多次提供國內實驗室或疫苗廠商進行內部標準品校正或不同新冠病毒檢驗方法校正之相關標準品,達成食藥署的階段性任務,及時解決當時國內各實驗室中和抗體含量檢測後資料不具可比性之困境。
2.產業效益:提供重要檢體資源,協助產業界快速取得專案製造許可
A.百歐生命科技股份有限公司
AllBio COVID-19 IgG & IgM Detection Kit取得核可認證項目如下
1.台灣TFDA防疫專案製造許可
2.歐盟CE認證
3.泰國FDA認證
B.福又達生物科技股份有限公司
產品名稱:福又達新冠肺炎IgG抗體檢測試劑組;防疫專案核准製造第1106801720號)。已取得台灣TFDA防疫專案製造許可專案製造許可
C.洹藝科技股份有限公司
產品名稱:百敏析SARS-CoV-2 IgG抗體檢測套組;防疫專案核准製造第1106815631號。已取得台灣TFDA防疫專案製造許可 (110-12-16)。
D.瀚源生醫股份有限公司
預計111年送IVDR。



